Азотная кислота молекулярная формула. Азотная кислота
ОПРЕДЕЛЕНИЕ
Чистая азотная кислота - бесцветная жидкость, при -42 o С застывающая в прозрачную кристаллическую массу (строение молекулы показано на рис. 1).
На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары её образуют с влагой воздуха мелкие капельки тумана.
Азотная кислота не отличается прочностью. Уже под влияние света она постепенно разлагается:
4HNO 3 = 4NO 2 + O 2 + 2H 2 O.
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
Рис. 1. Строение молекулы азотной кислоты.
Таблица 1. Физические свойства азотной кислоты.
Получение азотной кислоты
Азотная кислота образуется в результате действия окислителей на азотистую кислоту:
5HNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5HNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O.
Безводная азотная кислота может быть получена перегонкой при пониженном давлении концентрированного раствора азотной кислоты в присутствии P 4 O 10 или H 2 SO 4 в полностью стеклянном оборудовании без смазки в темноте.
Промышленный процесс производства азотной кислоты основан на каталитическом окислении аммиака над нагретой платиной:
NH 3 + 2O 2 = HNO 3 + H 2 O.
Химические свойства азотной кислоты
Азотная кислоты принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью диссоциирует на ионы. Её соли носят название нитраты.
HNO 3 ↔H + + NO 3 — .
Характерным свойством азотной кислоты является её ярко выраженная окислительная способность. Азотная кислота - один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор - в фосфорную. Тлеющий уголек, погруженный в концентрированную HNO 3 , ярко разгорается.
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы - в оксиды.
Концентрированная азотная кислота пассивирует некоторые металлы.
При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется диоксид азота. В случае более активных металлов - железа, цинка - образуется оксид диазота. Сильно разбавленная азотная кислота взаимодействует с активными металлами - цинком, магнием, алюминием - с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Cu + HNO 3 (conc) = Cu(NO 3) 2 + NO 2 + H 2 O;
Cu + HNO 3 (dilute) = Cu(NO 3) 2 + NO + H 2 O;
Mg + HNO 3 (dilute) = Mg(NO 3) 2 + N 2 O + H 2 O;
Zn + HNO 3 (highly dilute) = Zn(NO 3) 2 + NH 4 NO 3 + H 2 O.
При действии азотной кислоты на металлы водород, как правило, не выделяется.
S + 6HNO 3 = H 2 SO 4 + 6NO 2 + 2H 2 O;
3P + 5HNO 3 + 2H 2 O = 3H 3 PO 4 + 5NO.
Смесь, состоящая из 1 объема азотной и 3-4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов» — золото. Действие её объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила, NOCl:
HNO 3 + 3HCl = Cl 2 + 2H 2 O + NOCl.
Применение азотной кислоты
Азотная кислота - одно из важнейших соединений азота: в больших количествах она расходуется в производстве азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.
Примеры решения задач
ПРИМЕР 1
Азотная кислота (HNO 3), -- сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками. Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и t кип 120 °C при атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO 3 ·H 2 O) и тригидрат (HNO 3 ·3H 2 O).
Азот в азотной кислоте четырёхвалентен, степень окисления +5. Азотная кислота -- бесцветная газ, не имеет запаха, дымящая на воздухе жидкость, температура плавления? 41,59 °C, кипения + 82,6 °C с частичным разложением. Растворимость азотной кислоты в воде не ограничена. Водные растворы HNO 3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 -- концентрированной азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, d 20 = 1,41 г/см, T кип =120,7 °C). При кристаллизации из водных растворов азотная кислота образует кристаллогидраты:
- · моногидрат HNO 3 ·H 2 O, T пл = ?37,62 °C
- · тригидрат HNO 3 ·3H 2 O, T пл = ?18,47 °C
Твёрдая азотная кислота образует две кристаллические модификации:
- · моноклинная, пространственная группа P 2 1 /a, a = 1,623 нм, b = 0,857 нм, c = 0,631, в = 90°, Z = 16;
- · ромбическая
Моногидрат образует кристаллы ромбической сингонии, пространственная группа P na2, a = 0,631 нм, b = 0,869 нм, c = 0,544, Z = 4;
Плотность водных растворов азотной кислоты как функция её концентрации описывается уравнением
где d -- плотность в г/смі, с -- массовая доля кислоты. Данная формула плохо описывает поведение плотности при концентрации более 97 %.
Под действием света азотная кислота частично разлагается с выделением NО 2 и за cчет этого приобретает светло-бурый цвет:
N 2 + O 2 грозовые эл.разряды > 2NO
- 2NO + O 2 > 2NO 2
- 4НNО 3 свет > 4NО 2 ^(бурый газ) + 2Н 2 О + О 2
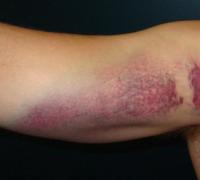
Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие органические вещества. Бумага и ткани разрушаются вследствие окисления образующих эти материалы веществ. Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту - жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок - ксантопротеиновая реакция). То есть - это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках.
Окислительные свойства азотной кислоты.
ОВР в статье специально выделены цветом . Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.
– в любом виде (и разбавленная, и концентрированная) является сильным окислителем.
Причем, разбавленная восстанавливается глубже, чем концентрированная.
Окислительные свойства обеспечиваются азотом в высшей степени окисления +5
Какая валентность у азота в этом соединении? Вопрос очень хитрый, многие отвечают на него корректно. У азота в азотной кислоте валентность IV .
Атом азота не может образовать больше ковалентных связей, посмотрите на электронную диаграмму:
Три связи с каждым атомом кислорода, и четвертая как бы распределяется, образуется полуторная связь. Таким образом, валентность азота IV, а степень окисления +5

Первое самое интересное свойство: взаимодействие с металлами.
Водород при взаимодействии с металлами никогда не выделяется
Схема реакции азотной кислоты (и разбавленной, и концентрированной) с металлами:
HNO 3 + Ме → нитрат + H 2 O + продукт восстановленного азота
Два нюанса:
1. , и с концентрированной азотной кислотой в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2. С платиной и золотом концентрированная азотная кислота не реагирует вообще.
Чтобы понять до чего вообще может восстанавливаться азот, посмотрим на диаграмму его степеней окисления:

Азот +5 – окислитель, будет восстанавливаться, то есть понижать степень окисления.
Все возможные продукты восстановления азотной на диаграмме обведены красным.
(Не все конечно, такие реакции вообще что угодно дать могут, но в ЕГЭ образуются только эти).
Определить какой именно продукт будет образовываться можно чисто логически:
- до таких низких степеней окисления как -3 или +1, с образованием продуктов NH 4 NO 3 или N 2 O соответственно, азот восстанавливают только достаточно сильные, активные металлы: щелочные — 1-я группа главная подгруппа, щелочноземельные, а так же Al и Zn . Как ранее уже было сказано, разбавленная кислота восстанавливается глубже, поэтому при взаимодействии активных металлов с конц. азотной кислотой образуется N 2 O , а при взаимодействии с разб. азотной кислотой NH 4 NO 3 .
4Ba + 10HNO 3( конц .) → 4Ba(NO 3 ) 2 + 5H 2 O + N 2 O
4Ba + 10HNO 3( разб .) → 4Ba(NO 3 ) 2 + 3H 2 O + NH 4 NO 3
8Li + 10HNO 3( конц .) → 8LiNO 3 + 5H 2 O + N 2 O
8Li + 10HNO 3( разб .) → 8LiNO 3 + 3H 2 O + NH 4 NO 3
8Al + 30HNO 3( конц .) (t)→ 8Al(NO 3 ) 3 + 15H 2 O + 3N 2 O
8Al + 30HNO 3( разб .) → 8Al(NO 3 ) 3 + 9H 2 O + 3NH 4 NO 3
Остальные металлы восстанавливают азотную кислоту до +2 или +4, с образованием продуктов соответственно: NO или O 2 .
Разбавленная кислота восстанавливается глубже
- при взаимодействии с ней металлов, не отличающихся особой активностью, будет образовываться NO . Ну а с конц. азотной NO 2:
Cu + 4HNO 3( конц .) → Cu(NO 3 ) 2 + 2H 2 O + 2NO 2
3Cu + 8HNO 3( разб .) → 3Cu(NO 3 ) 2 + 4H 2 O + 2NO
Fe + 6HNO 3( конц .) (t)→ Fe(NO 3 ) 3 + 3H 2 O + 3NO 2
Fe + 4HNO 3( разб .) → Fe(NO 3 ) 3 + 2H 2 O + NO
(обратите внимание, что железо окисляется до высшей степени окисления)
Ag + 2HNO 3( конц .) → AgNO 3 + H 2 O + NO 2
3Ag + 4HNO 3( разб .) → 3AgNO 3 + 2H 2 O + NO
Если тяжело сразу понять всю логичность выбора, вот таблица:

А зотная кислота окисляет неметаллы до высших оксидов .
Так как неметаллы – не такие сильные восстановители, как активные металлы, азот может восстановиться только до +4, образовав NO 2 или NO соответственно.
При окислении неметаллов концентрированной азотной кислотой образуется бурый газ (NO 2), а если кислота разбавленная, то образуется NO . Схемы реакций следующие:
неметалл + HNO 3 (разб.) → + NO
неметалл + HNO 3 (конц.) → соединение неметалла в высшей степени окисления + NO 2
4 HNO 3(конц.) → CO 2 + 2 H 2 O + 4 NO 2
3C + 4HNO 3( разб .) → 3CO 2 + 2H 2 O + 4NO
(угольная кислота не образуется, так как она не стабильна)
5HNO 3( конц .) → H 3 PO 4 + H 2 O + 5 NO 2
3P + 5HNO 3( разб .) + 2H 2 O → 3H 3 PO 4 + 5NO
+ 3 HNO 3( конц .) → H 3 BO 3 + 3NO 2
B + HNO 3( разб .) + H 2 O → H 3 BO 3 + NO
6HNO 3( конц .) → H 2 SO 4 + 2H 2 O + 6NO 2
S + 2HNO 3( разб .) → H 2 SO 4 + 2 NO
- концентрированная азотная кислота окисляет сероводород. Окисление идет глубже при нагревании:
2HNO 3( конц .) + H 2 S → S↓ + 2NO 2 + 2H 2 O
H 2 S + 8HNO 3(конц.) → H 2 SO 4 + 8 NO 2 + 4 H 2 O
- концентрированная азотная кислота окисляет сульфиды до сульфатов:
CuS + 8HNO 3(конц.) → CuSO 4 + 4 H 2 O + 8 NO 2
- азотная кислота настолько сурова, что может окислить даже . Только один – иод. Разбавленная восстанавливается глубже: до +2, концентрированная до +4. А вот иод окисляется не до высшей степени окисления +7 (слишком круто), а до +5, образуя иодноватую кислоту HIO 3:
10 HNO 3(конц.) + I 2 (t)→ 2HIO 3 + 10NO 2 + 4H 2 O
10 HNO 3(разб.) + 3 I 2 (t) → 6HIO 3 + 10NO + 2H 2 O
- концентрированная азотная кислота реагирует с хлоридами и фторидами. Только следует понимать, что с фторидами и хлоридами протекает обычная реакция ионного обмена с вытеснением галогеноводорода и образованием нитрата:
NaCl (тв.) + HNO 3(конц.) → HCl + NaNO 3
NaF (тв.) + HNO 3(конц.) → HF + NaNO 3
- А вот с бромидами и иодидами (и с бромоводородами, и с иодоводородами) протекает ОВР. В обоих случаях образуется свободный галоген, а азот восстанавливается до NO 2:
8HNO 3( конц .) + 6KBr ( тв .) → 3Br 2 + 4H 2 O + 6KNO 3 + 2NO 2
4HNO 3( конц .) + 2NaI ( тв .) → 2NaNO 3 + 2NO 2 + 2H 2 O + I 2 ↓
7HNO 3( конц .) + NaI → NaNO 3 + 6NO 2 + 3H 2 O + HIO 3
То же самое происходит при взаимодействии с иодо- и бромоводородами:
2HNO 3( конц .) + 2HBr → Br 2 + 2NO 2 + 2H 2 O
6HNO 3( конц .) + HI → HIO 3 + 6NO 2 + 3H 2 O
Реакции с золотом, магнием, медью и серебром
И воду.
В полумраке же, кислота с водой легко смешивается в любых пропорциях. У вещества есть и кристаллическое состояние.
Оно может быть моноклинным и ромбическим. Это указывает на форму ячеек кристаллической решетки.
Моноклинная составлена из наклоненных параллелепипедов, а ромбическая, соответственно, из ромбов.
Отличаются ли свойства растворов от ее , как вещество добывается и где применяется? Вопросы заданы, остается дать на низ ответы.
Свойства азотной кислоты
В обычных условиях кристаллическую кислоту можно лицезреть лишь в жарких странах.
В состояние бесцветная жидкость переходит лишь при 42-ух градусах Цельсия. До этой отметки вещество остается жидким и парит.
При этом, реагент источает резкий, удушливый запах. С ним, собственно, связана история открытия азотной кислоты . Обнаружил ее Даниэль Резерфорд.
Шотландец изучал продукты сжигания , , . В ходе работ выделялся газ, который химик назвал удушливым воздухом.
Ученый отметил, что вещество не поддерживает горение и непригодно для дыхания.
Позже, выяснилась формула азотной кислоты : — HNO 3 . Получается, вещество одноосновное.
Так именуют , в состав которых входит лишь один атом водорода. С водой вещество смешивается в любых пропорциях.
Поэтому, существует концентрированная азотная кислота и неконцентрированная.

Первая активно дымит, то есть, летуча. Химические свойства концентрата разнятся с разбавленой версией.
Если кислоты в растворе около 60%, он будет реагировать со всеми металлами кроме , , , , , и .
Отсюда вывод, в какой таре нужно хранить вещество. и фляги, конечно, не выгодны.
А вот емкости из железа и алюминия и бюджетны, и надежны, поскольку закрывают кислоту от света. Главное, не выбрать тару из меди. Азотная кислота ее растворит.
Реагируя с металлами, концентрированный раствор азотной кислоты выделяет бурый газ. Его формула: — NО 2 .
Параллельно, образуются кислоты. В зависимости от растворенного металла, реакции разнятся.
При взаимодействии с рядом до , образуются диоксиды, и выделяется кислород.
Реакция с солями металлов, находящимися после магния до , дает бурый газ, оксид азота и кислород.
Если к кислоте присоединится соль любого металла после меди, металл отделится. Вместе с ним выделяются бурый газ и кислород.
Разбавленная азотная кислота реагирует с большинством тех же металлов, но, окисляется при этом до аммиака.
К такому исходу приводит взаимодействие, к примеру, с и элементами щелочноземельной группы. В реакцию вступает и железо.
Так что, разбавленную кислоту в емкостях из с феррумом лучше не хранить.
Итогом взаимодействия с азотной кислотой разбавленного типа может стать не только аммиак, но и аммиачная селитра.
Самый редкий вариант – закись азота. Ее даст, к примеру, реакция с магнием. С остальными металлами азотная кислота образует оксид азота.
Его можно получить, в частности, при взаимодействии с . Выпадет оксид аргентума, образуется вода и оксид азота.
По этой же схеме проходят реакции кислоты с неметаллами, только, вместо формируется серная кислота.

Из реакций с другими кислотами примечательно смешивание с соляной. Последней, берут 3 части, а первой – одну. Получается .
Ее так назвали, поскольку вещество растворяет даже – металл правителей, сильных мира сего.
На такое не способна ни одна из чистых кислот. Благородные металлы им поддаются редко, а , вовсе, никогда.
Добыча азотной кислоты
В малых количествах вещество возможно добывать даже из воздуха, причем, в прямом смысле. Не секрет, что азот – одна из составляющих атмосферы.
На 15-ый газ в ней приходятся 78% . Азот реагирует с кислородом, образуя оксид. Дальнейшее окисление дает диоксид азота. Это тот самый бурый газ.
Он-то и реагирует с водой, взвесь которой, как известно, имеется в воздухе. Вступая в контакт с облаками, туманом, бурый газ переходит в азотную кислоту.
Массовая доля азотной кислоты в атмосфере столь мала, что вещество не наносит вред человеку, да и другим живым организмам.
Для промышленной добычи кислота из воздуха тоже не годится. На заводах пользуются иными схемами.
Первая: — производство азотной кислоты из аммиака. Сначала, проводят его конверсию, то есть, дробление состава исходной газовой смеси.
Реакция проходит на платинородиевых сетках при температуре около 1000 градусов Цельсия. Так получают оксид азота. Его окисляют до диоксида.
Это вторая стадия процесса. После, оксиды азота абсорбируют водой. В итоге, получается азотная кислота и чистая вода.
Описанный метод приводит к образованию разбавленной кислоты. Возможна последующая концентрация.
Поэтому, метод наиболее популярен, ведь потребителям нужна, как насыщенная, так и ненасыщенная кислоты.

Работая с аммиаком, промышленники «убивают одним выстрелом двух зайцев».
Второй метод производства реактива приводит сразу к получению концентрата. Речь о прямом синтезе из оксидов азота. Берут жидкие.
Они взаимодействуют с водой и кислородом. Такие реакции с азотной кислотой проходят под давлением в 5 мегапаскалей.
Получается диоксид азота. В обычных условиях он переходит в жидкое состояние. Окисление аммиака дает двойной оксид азота.
В газовой смеси его около 11%. Сжижжают диоксид под давлением. При стандартных условиях переход невозможен.
Применение азотной кислоты
Как составная царской водки азотная кислота является частью кислот. С их помощью изучают качество .
Без соответствующих исследований не поступят в , а – на прилавки .
Прежде чем апробировать и продать драгоценный металл, его нужно добыть. В этом тоже помогают азотная кислота и царская водка.
Ими обрабатывают руды, выводя нужные элементы в раствор. Остается осадить металлы и осушить, очистить от примесей. Так добывают не только благородные, но и неблагородные элементы.
Из металлов, как известно, делают , а из них, к примеру, технику. Если рассматривать воздушную и космическую, в них присутствует чистая кислота.
Ее примешивают к топливу, получая оксид. Азотная кислота выступает в роли окислителя. .
Все это соли, объединенные названием «селитры». Азот позволяет растениям быстро развиваться, повышает урожайность.
Дело в том, что 15-ый элемент входит в состав хлорофилла. Это зеленый пигмент растений, отвечающий за усвоение энергии .
Чем больше освоенной энергии, тем лучше развитие трав, кустарников, деревьев.
Слово «селитра» на слуху и у пиротехников. Азотная кислота – основа взрывчатых веществ.
Аммиачной селитры в большинстве из них около 60%. Остатки – дизельное топливо, или иное горючее. Получить можно, как безобидный фейерверк, так и военную бомбу.
Цена азотной кислоты
Азотная кислота, как и большинство востребованных кислот, бывает чистой и технической, отягощенной примесями. Последняя дешевле.
Чистый реагент дороже. Для справки, ГОСТ 4461-77 – норма для очищенной кислоты.
Реагент российского производства стоит в районе 30-55-ти рублей за килограмм. Ценник зависит от концентрации раствора.
Для технической кислоты верхний ценовой предел, обычно, составляет 40 за кило. Предусмотрена и большая фасовка.
Есть, к примеру, 25-литровые канистры, в которые разливается азотная кислота.
Купить реагент с максимальной выгодой позволяют оптовые заказы. Такие уходят на предприятия, где знают правила обращения с реагентом.

Он разъедает не только металлы, но и слизистые. Пары вещества могут затруднить дыхание, повредить трахеи, выстилающие ткани носа.
Поэтому, с кислотой работают лишь в масках. При нарушении правил, кроме трудностей с дыханием, наступает отравление.
Интоксикация выражается в рвоте, чесотке, нарушениях зрения, обоняния. Более-менее безобидны лишь слабые растворы реагента.
Именно такие, к примеру, используют в школьных лабораториях. Учиться обращению с химическими реагентами стоит с малых лет.
Одноосновная сильная кислота, представляющая собой в стандартных условиях бесцветную жидкость, которая при хранении желтеет, может находиться в твердом состоянии, характеризующемся двумя кристаллическими модификациями (моноклинная или ромбическая решетки), при температурах ниже минус 41,6 оС. Это вещество с химической формулой — HNO3 — называется азотная кислота. Имеет молярную массу 63,0 г/моль, а ее плотность соответствует 1,51 г/см³. Температура кипения кислоты равняется 82,6 оС, процесс сопровождается разложением (частичным): 4HNO3 → 2H2O + 4NO2 + O2. Раствор кислоты с массовой долей основного вещества, равной 68 % кипит при температуре 121 оС. чистого вещества соответствует 1,397. Кислота способна смешиваться с водой в любых соотношениях и, являясь сильным электролитом, почти полностью распадаться на ионы H+ и NO3-. Твердые формы — тригидрат и моногидрат имеют формулы: HNO3 . 3H2O и HNO3 . H2O соответственно.
Азотная кислота — коррозионно активное, токсическое вещество и сильный окислитель. Со средних веков известно такое название, как «сильная вода» (Aqua fortis). Алхимики, открывшие кислоту в 13 веке, дали такое название, убедившись в ее необычайных свойствах (разъедала все металлы, кроме золота), превосходящих в миллион раз силу уксусной кислоты, которую в те времена считали самой активной. Но еще через три столетия было установлено, что разъедать, даже золото, может смесь таких кислот, как азотная и соляная в объемном соотношении 1:3, которую по этой причине и назвали «царская водка». Появление желтого оттенка при хранении объясняется накоплением в ней окислов азота. В продаже кислота чаще бывает с концентрацией 68 %, а при содержании основного вещества более 89 % ее называют «дымящей».
Химические свойства азотной кислоты отличают ее от разбавленной серной или соляной кислот тем, что HNO3 более сильный окислитель, поэтому никогда не выделяется водород в реакциях с металлами. Благодаря окислительным свойствам она реагирует также с многими неметаллами. И в том, и другом случае всегда образуется диоксид азота NO2. В окислительно-восстановительных реакциях восстановление азота происходит до различной степени: HNO3, NO2, N2O3, NO, N2O, N2, NH3, что определяется концентрацией кислоты и активностью металла. В молекулах образующихся соединений содержится азот со степенью окисления: +5, +4, +3, +2, +1, 0, +3 соответственно. Например, медь окисляется концентрированной кислотой до нитрата меди (II): Cu + 4HNO3 → 2NO2 + Cu(NO3)2 + 2H2O, а фосфор — до метафосфорной кислоты: P + 5HNO3 → 5NO2 + HPO3 + 2H2O.
Иначе взаимодействует разбавленная азотная кислота с неметаллами. На примере реакции с фосфором: 3P + 5HNO3 +2H2O → 3H3PO4 + 5NO видно, что азот восстанавливается до двухвалентного состояния. В результате образуется монооксид азота, а фосфор окисляется до Концентрированная азотная кислота в смеси с соляной кислотой растворяет золото: Au + 4HCl + HNO3 → NO + H + 2H2O и платину: 3Pt + 18HCl + 4HNO3 → 4NO +3H2 + 8H2O. В этих реакциях на начальном этапе соляная кислота окисляется азотной с выделением хлора, а затем металлы образуют комплексные хлориды.
Азотная кислота в промышленных масштабах получается тремя основными способами:
- Первый — взаимодействием солей с серной кислотой: H2SO4 + NaNO3 → HNO3 + NaHSO4. Раньше это способ был единственным, но, с появлением других технологий, в настоящее время его используют в лабораторных условиях для получения дымящей кислоты.
- Второй — это дуговой способ. При продувании воздуха через с температурой от 3000 до 3500 оС, часть азота воздуха реагирует с кислородом, при этом образуется монооксид азота: N2 + O2 → 2NO, который после охлаждения окисляется до диоксида азота (при высокой температуре монооксид с кислородом не взаимодействует): O2 + 2NO → 2NO2. Затем, практически, весь диоксид азота, при избытке кислорода, растворяется в воде: 2H2O +4NO2 + O2 → 4HNO3.
- Третий — это аммиачный способ. Аммиак окисляется на платиновом катализаторе до монооксида азота: 4NH3 + 5O2 → 4NO + 6H2O. Образовавшиеся нитрозные газы охлаждаются, и образуется диоксид азота, который поглощается водой. Этим способом получают кислоту с концентрацией от 60 до 62 %.
Азотная кислота в промышленности широко применяется для получения лекарств, красителей, азотных удобрений и солей азотной кислоты. Кроме того, она используется для растворения металлов (например, медь, свинец, серебро), которые не реагируют с другими кислотами. В ювелирном деле используется для определения золота в сплаве (это способ является основным).